
Una de las principales funciones del sistema inmunitario es defender al individuo de microorganismos patógenos. Este sistema está conformado por una intricada red de células y mediadores que actúan como reguladores positivos o negativos ante la amenaza de un patógeno.
Las células del sistema inmunitario se dividen en varias poblaciones, y a una de ellas se la conoce con el nombre de “linfocitos T”. A su vez, existen distintas subpoblaciones de linfocitos T: mientras que algunos intervienen en la eliminación de células que han sido infectadas por algún patógeno, otras secretan una gran cantidad de mediadores solubles que activan a otras células inmunocompetentes y favorecen de este modo el desarrollo de la respuesta inflamatoria. Durante muchos años, los inmunólogos sospecharon que podría existir otra clase de linfocitos T, cuyas funciones fueran diametralmente opuestas: estas células deberían limitar o suprimir el desarrollo de la inflamación y mantener al sistema inmunitario bajo control a fin de impedir que por error o exceso, se dañen los órganos y tejidos del individuo. Estas células fueron finalmente identificadas hace poco más de una década, y se las “bautizó” con el nombre de “linfocitos T reguladores” (Tregs).
Actualmente, la comunidad científica muestra un grán interés en la manipulación de estas células y su posterior uso terapéutico en seres humanos. A partir de esta perspectiva, se desarrollaron protocolos destinados a incrementar o reducir tanto su número como su acción supresora. Por ejemplo, la potenciación de la capacidad inmunosupresora de estas células evitaría el rechazo inmune a los trasplantes y favorecer la condición clínica en distintas enfermedades autoinmunes. En forma inversa, la eliminación de esta población podría optimizar el tratamiento contra ciertas infecciones crónicas difíciles de erradicar, ya que los microorganismos que las causan suelen evadir el ataque del sistema inmune o bien manipularlo para su propia conveniencia. A pesar de que aún resta mucho por resolver para su amplia utilización en el campo clínico, los resultados obtenidos hasta el momento son muy prometedores.
En uno de los institutos del CCT, el Instituto de Innunología Clinica y Experimental de Rosario (IDICER), un grupo de investigadores buscan establecer cual es la participación de estas células en dos enfermedades infecciosas que representan un serio problema de Salud Pública: La Tuberculosis (producida por la micobacteria Mycobcterium tuberculosis) y la enfermedad de Chagas (causada por el parásito Trypanosoma cruzi). La Tuberculosis es una enfermedad curable y prevenible en algunas formas clínicas a través de la vacunación, sin embargo actualmente causa alrededor de 2 millones de muertes anuales en todo el mundo. En lo que respecta a la enfermedad de Chagas, se estima que hay alrededor de 7 millones de personas infectadas por T. cruzi; y si bien la mayoría de ellas se encuentran en América Latina, su número va en aumento en los países del primer mundo a causa de las corrientes emigratorias. Ambos patógenos presentan algunas características comunes: son de vida intracelular y tienden a establecer infecciones crónicas que dañan diversos órganos, fundamentalmente el pulmón en la Tuberculosis y el corazón en la enfermedad de Chagas. Además, a través de distintos factores de virulencia.
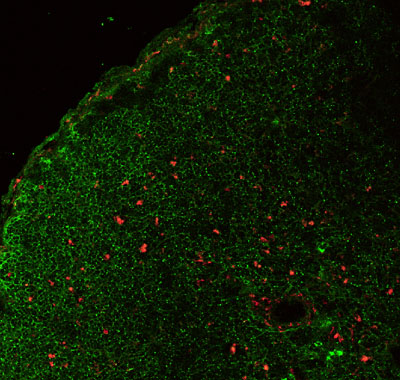
Foto: Las células Tregs expresan un marcador que las identifica, llamado FoxP3. Mediante microscopía confocal, puede identificarse a las células que expresan este marcador. En la foto puede apreciarse las células que expresn Foxp3 (en rojo) en el estroma tímico (en verde) durante la infección por T. cruzi.
Existe muy poca información sobre la dinámica de las Tregs durante los procesos infecciosos. Los trabajos recientemente publicados por los investigadores del IDICER indican que las formas mas severas de ambas infecciones tienden a cursar con marcadas alteraciones en esta población. En pacientes con infección activa de M. tuberculosis, si bien la población de Tregs aumenta, no lograría controlar el desarrollo excesivo de la respuesta inflamatoria que genera un extenso daño a nivel pulmonar. Contrariamente, en un modelo experimental agudo y letal de enfermedad de Chagas, esta población disminuye dramáticamente. En este modelo, una novedosa inmunoterapia en base a IL-2 y glucocorticoides favoreció la expansión de las Tregs y disminuyó la mortalidad asociada a la infección. Estos hallazgos revelan que las Tregs tienen un papel indiscutible en la inmunopatología asociada a estas infecciones y sientan las bases para estrategias de manipulación de las células T reguladoras con miras a una nueva modalidad de intervención terapéutica para ambas enfermedades.
Publicaciones relacionadas:
Trypanosoma cruzi Experimental Infection Impacts on the Thymic Regulatory T Cell Compartment.González FB, Calmon-Hamaty F, Nô Seara Cordeiro S, Fernández Bussy R, Spinelli SV, D'Attilio L, Bottasso O, Savino W, Cotta-de-Almeida V, Villar SR, Pérez AR.
PLoS Negl Trop Dis. 2016 Jan 8;10(1):e0004285.
Increased frequency of CD4+ CD25+ FoxP3+ T regulatory cells in pulmonary tuberculosis patients undergoing specific treatment and its relationship with their immune-endocrine profile.Díaz A, Santucci N, Bongiovanni B, D'Attilio L, Massoni C, Lioi S, Radcliffe S, Dídoli G, Bottasso O, Bay ML.
J Immunol Res. 2015;2015:985302.
Immunoendocrine dysbalance during uncontrolled T. cruzi infection is associated with the acquisition of a Th-1-like phenotype by Foxp3(+) T cells.González FB, Villar SR, Fernández Bussy R, Martin GH, Pérol L, Manarin R, Spinelli SV, Pilon C, Cohen JL, Bottasso OA, Piaggio E, Pérez AR.
Brain Behav Immun. 2015 Mar;45:219-32.

